产品货号 | 产品规格 | 目录价 | 促销价 |
HX2014S | 1 ml | 187.00 | 168.00 |
HX2014M | 5 ml | 564.00 | 508.00 |
HX2014L | 20 ml | 1365.00 | 1228.00 |
HX2014XL | 100 ml | 4109.00 | 3698.00 |
▍产品信息
RNA Clean Magnetic Beads(RNA纯化磁珠)是基于固相载体可逆化固定(Solid phase reverse immobilization, SPRI)技术,使用新型核酸纯化介质包被的磁珠,配合优化的缓冲体系,用于稳定、高效、便捷地从常见酶反应体系中纯化RNA或cDNA。RNA纯化和杂质的去除对于RNA相关的实验是非常重要的,包括RNA-seq、qPCR、微阵列(Microarray)等。RNA纯化磁珠,也被称为DNA/RNA提取纯化磁珠、RNA Cleanup & Concentration、NGS Cleanup Magnetic Beads、RNA Clean & Concentrator、RNA Clean-Up、RNA Cleaner等。既适用于RNA的纯化,也适用于cDNA或其它DNA的纯化,不能特异性区分RNA或DNA,也不能用于从细胞或组织中直接提取RNA,但可以通过相应的DNA酶或RNA酶处理后再进行RNA或DNA纯化。
本产品使用便捷,通常15 min内即可完成RNA样品的纯化,回收率可以达到90%以上,适用于低浓度RNA的浓缩。结合量高,对不同体系的RNA可以快速进行分离纯化,不易产生非特异吸附,可以快速有效去除未掺入的dNTP或NTP、引物、引物二聚体、盐和其它杂质。不仅适用于少量样本的手工操作,也适用于高通量(High-throughput screening)的自动化操作系统(自动化移液工作站)。与传统的RNA回收方法相比,避免了酚、氯仿等有机溶剂的使用,更加安全。主要操作流程图如1所示。样品中的RNA与磁珠结合,在外界磁场(如磁分离架)的作用下,磁珠与相应溶液可以快速而高效地分离,经洗涤充分去除杂质,最后用洗脱液将RNA从磁珠上洗脱下来,即可获得高度纯化的RNA样品。
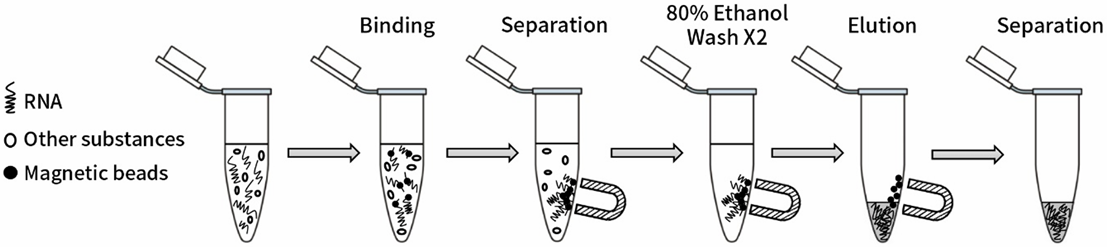
图1. RNA Clean Magnetic Beads(RNA纯化磁珠)实验流程示意图
▍产品应用
可广泛应用于基因测序以及分子诊断等领域,尤其适用于rRNA去除后或DNase I酶处理后的RNA纯化、体外转录产物纯化及二代测序(Next generation sequencing, NGS)文库构建过程中的RNA纯化。
▍产品保存
-20℃保存。
▍产品组分
组分编号 | 组分名称 | 组分规格 | |||
HX2014 | RNA Clean Magnetic Beads(RNA纯化磁珠) | 1 ml | 5 ml | 20 ml | 100 ml |
▍注意事项
1. 需自备无水乙醇和磁分离装置,本产品的所用试剂和耗材都要求是RNase-free,操作过程要严格保证无RNase污染,请戴上口罩和手套操作,尽量防止人体表面的RNase污染样品。如果耗材可能有RNase污染,可考虑用0.01%的DEPC水浸泡过夜,然后高温高压灭菌并烘干。
2. 本产品避免冷冻、避免高速离心。为保证RNA的回收效率,使用前须将磁珠由4ºC冰箱取出,或取所需量,待其温度平衡至室温后再使用。分装或使用磁珠时,请适当漩涡震荡或反复颠倒以保证磁珠充分混匀。
3. 80% (v/v)乙醇溶液推荐现用现配,否则后续使用时可能会因为乙醇的挥发而影响回收效率。
4. 请勿长时间干燥磁珠,干燥过度将导致磁珠的不可逆聚集,从而降低洗脱效率。
5. 本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。为了您的安全和健康,请穿实验服并戴一次性手套操作。
1. 将磁珠溶液从4ºC冰箱取出,适当漩涡震荡或充分颠倒以保证磁珠充分混匀,然后取出所需的量,平衡至室温。
2. 配制新鲜的80% (v/v)乙醇溶液。将0.5-5 µg RNA样本转移到洁净的RNase-free 1.5 ml离心管。根据样本体积,参照下表用量加入RNA Clean Magnetic Beads(使用前务必混匀),一般磁珠用量是样品体积的2倍。
样品体积(µl) | 磁珠体积(µl) |
50 | 100 |
100 | 200 |
150 | 300 |
200 | 400 |
3. 轻柔涡旋震荡或移液器吹打10次混匀,室温孵育5 min。随后将离心管置于磁力架的磁珠中,室温孵育30 sec,小心移除上清。
4. 保持离心管始终处于磁力架中,加入200 µl新鲜配制的80% (v/v)乙醇溶液漂洗磁珠,室温孵育30 sec,小心移除上清。
5. 重复步骤4一次。保持离心管始终处于磁力架中,打开离心管盖,室温干燥至磁珠刚刚出现龟裂状(约5-10 min)。
6. 将离心管从磁力架中取出,加入适量超纯水(10-30 µl),轻柔涡旋震荡或使用移液器轻轻吹打以充分混匀,室温孵育5 min。
7. 将离心管短暂低速离心后置于磁力架中分离5 min,待溶液澄清后,小心吸取上清至洁净的离心管中,即完成RNA的纯化。
注:
1) 因为乙醇和水混合后体积会发生改变,所以请勿量取8 ml乙醇,加超纯水或双蒸水定容至10 ml。例如要分别量取8 ml无水乙醇和2 ml超纯水或双蒸水(RNase free),混匀后即得约10 ml 80% (v/v) 乙醇溶液。
2) 磁珠在使用前一定要适当涡旋震荡或吹打混匀。如果希望提升RNA回收效率,可适当增加磁珠用量,延长结合时间。
3) 一般情况下磁珠用量为样品体积的1.8-2.0倍,用户也可根据实际测试效果对磁珠用量进行适当的调整。磁珠晾干要避免过度干燥,过度干燥会导致RNA的洗脱效率降低。
4) 建议转移上清时保留少量液体以免吸到磁珠影响后续实验。纯化得到的RNA极易降解,建议尽快进行下一步实验。短时间内不使用时请置于-80ºC保存。
Q:RNA得率低是什么原因呢?
A:样本起始量不足(如细胞或组织量少),裂解不充分,RNA未完全释放,磁珠结合效率低(缓冲液pH、乙醇浓度不合适),RNA在操作中降解(未使用RNase-free耗材或试剂)。
Q:RNA洗脱效率低是什么原因呢?
A:洗脱液体积过少或未使用无RNase水,磁珠过度干燥(导致RNA难以溶解),洗脱时间不足。